Syndromes post-infectieux, leurs caractéristiques principales et leur variabilité.
Au départ de cette revue, il y a une interrogation et une affirmation.
L'interrogation est la suivante : comment expliquer que 3 SPI différents (Covid long, SFC, Lyme long) partagent un nombre aussi élevé de symptômes variés, qu'ils aient tant de points communs qu'il n'est pas toujours évident de savoir de quel SPI souffre un patient, mais qu'en même temps les tableaux cliniques de deux patients souffrant du même SPI (Covid long par exemple) peuvent être bien différents ? Parmi les symptômes les plus souvent partagés se trouvent la fatigue, le brouillard cérébral (troubles de la mémoire et de l'attention), différentes douleurs. La revue liste une cinquantaine de symptômes, que l'on peut rencontrer dans quasiment tous les SPI, bien que chaque patient ne souffre que de certains d'entre eux.
Par ailleurs, dans cette revue, j'affirme mon désaccord avec deux points de vue sur les SPI que l’on rencontre fréquemment. 1) Je suis en désaccord avec ceux qui pensent que le traitement des SPI pourrait reposer uniquement sur la prise de médicaments, par exemple, uniquement des antibiothérapies prolongées pour le Lyme long, ou bien une liste aussi longue que coûteuse de compléments alimentaires ou de phytothérapies. 2) Je suis encore plus en désaccord avec l'approche psychosomatique qui cherche à interpréter les SPI uniquement en termes psychiatriques, en ignorant totalement la richesse et la complexité des interactions bidirectionnelles entre le cerveau et les autres organes.
Importance du terrain
Je propose de considérer les SPI comme un ensemble de pathologies dues à une mauvaise résolution de réponses inflammatoires et neuro-immunitaires provoquées par l'infection. Après certaines infections, que ce soit par le SARS-CoV-2, par Borrelia, ou par EBV (Epstein-Barr virus, qui provoque une mononucléose), environ 90% des personnes infectées guérissent sans séquelle, mais, dans chaque cas, environ 10% d'entre elles (les personnes dites susceptibles), basculent dans une nouvelle pathologie qui peut s'atténuer en quelques mois ou durer des années. J'émets l'hypothèse que le risque de développer un SPI dépend de chaque terrain individuel, déterminé par la combinaison de la génétique, l'épigénétique, le mode de vie, les antécédents infectieux, etc. L'agent infectieux ne déclenche un SPI qu’en présence d’un terrain individuel approprié, lequel peut être très différent d'un individu à un autre. C'est cette diversité qui expliquerait la grande hétérogénéité des manifestations du SPI.
Nous verrons dans ce texte plusieurs fragilités susceptibles de favoriser le développement d'un SPI. Par exemple, on sait qu'un terrain atopique (propension à développer des allergies) est un des facteurs de risque de COVID long. En outre, les symptômes d'activation des mastocytes[1] sont présents dans certains COVID longs, qui évoquent parfois un SAMA (syndrome d'activation mastocytaire). Et en effet, des traitements antihistaminiques ont prouvé leur efficacité, dans une sous-population de patients présentant un COVID long, sur plusieurs symptômes tels que la fatigue, les symptômes digestifs et neurocognitifs.
La plupart des symptômes d'un SPI sont communs à d'autres SPI, qu'ils soient cardiothoraciques, digestifs, musculaires, ophtalmiques, cutanés, ou psychologiques. Or, si l'on compare deux déclencheurs de SPI possibles, comme SARS-CoV-2 et Borrelia, on voit bien que ce virus et cette bactérie n'ont pas grand-chose en commun. Ce n'est donc pas dans leurs propriétés spécifiques qu'il faut chercher la racine des SPI, mais c'est bien dans les terrains individuels, dont ces perturbateurs vont soudain bouleverser l'équilibre. Je reviendrai sur les différents facteurs susceptibles d'amplifier et de chroniciser la pathologie.
[1] Les mastocytes sont des cellules immunitaires utiles dans la défense anti-infectieuse, mais dont l'activation excessive, indue, est un élément-clé de l'allergie. L'histamine est une des molécules sécrétés en abondance par les mastocytes activés.
Lutter contre des pathogènes, mais lesquels ?
Plusieurs pathogènes différents peuvent contribuer à la chronicité de la maladie : 1) Le pathogène déclencheur, par exemple SARS-CoV-2 ou Borrelia 2) Nos organismes hébergent tous un certain nombre de virus latents (EBV, CMV, HHV-6), qui restent normalement sous les radars, et sont contrôlés par un système immunitaire sain. Mais dans la plupart des SPI on observe une réactivation de virus latents, sans doute rendue possible par l'affaiblissement du système immunitaire consécutif à l'infection initiale. La réactivation de virus latents aggravera cette faiblesse immunitaire. 3) Des bactéries du microbiote intestinal peuvent parfois franchir une muqueuse intestinale fragilisée par l'infection initiale, et passer dans le sang. C'est ce qu'on appelle la translocation bactérienne intestinale. Elle peut aboutir par exemple à ce qu'une bactérie intestinale comme Salmonella soit retrouvée dans des articulations, où elle ne devrait absolument pas se trouver, et où elle va pouvoir provoquer ou entretenir une inflammation locale, comme déportée à distance de l'inflammation intestinale, qui est très fréquente dans les SPI (et dans bien d'autres maladies). 4) Des levures comme Candida albicans, peuvent proliférer quand le microbiote intestinal est déséquilibré, que ce soit par l'infection initiale ou par une prise d'antibiotiques prolongée.
La bonne santé est caractérisée par la relative stabilité de nombreuses variables de notre corps (taux de glucose dans le sang, pression artérielle, rythme cardiaque, température etc…). Cet équilibre, cette "homéostasie" est le résultat d'un ajustement permanent et automatique, de ces variables. Quand un SPI s'est installé, qu'un équilibre a été rompu, des phénomènes en cascade peuvent s'enchainer et entrainer un état dont il est ensuite difficile de sortir. On parle alors de dyshoméostasie. Pour sortir de cette dyshoméostasie, la lutte contre des pathogènes impliqués dans un SPI prolongé ne doit donc pas être uniquement orientée contre le pathogène déclencheur. On doit aussi prendre en compte les pathogènes secondaires, ce qui peut amener à des prises en charge apparemment paradoxales. Par exemple, un traitement antibiotique est a priori tout à fait inapproprié contre une infection virale (par SARS-CoV-2 par exemple. Mais si cette infection a déclenché une translocation bactérienne intestinale, il pourrait être nécessaire d'en limiter les conséquences par un traitement antibiotique. Ceci, au cas où le médecin traitant a décelé des signes de translocation intestinale, car ce serait une erreur évidente de promouvoir de façon aveugle des traitements antibiotiques systématiques et infondés.
De la même façon (paradoxale), si dans un Lyme long (donc déclenché par une bactérie), il y a des signes de réactivation marquée de virus latents, on peut réfléchir à un traitement par un antiviral ciblant les herpesvirus (la plupart des virus latents font partie de ce groupe de virus).
SPI et dysfonctionnement mitochondrial
Toutes nos cellules ont besoin d'énergie pour fonctionner et ne pas mourir. Le carburant utilisé par toutes nos cellules, que ce soit des neurones, des cellules musculaires ou du foie (comme celles des autres animaux et même des plantes), c'est toujours l'ATP (adénosine triphosphate), un véritable carburant cellulaire universel. Si la production d'ATP devient insuffisante, les cellules manquent d'énergie, "leur batterie est à plat", une expression que connaissent bien les personnes souffrant de SPI. Chacune de nos cellules fabrique son ATP (en gros, à partir de glucose et d'oxygène) dans des petites centrales intracellulaires, les mitochondries. Lors de cette production d'ATP, les mitochondries produisent aussi un "déchet", les espèces réactives de l'oxygène (ROS, reactive oxygen species). De nombreuses données montrent que dans les SPI (comme dans d'autres maladies associées à une grande fatigue, à un manque d'énergie, comme le cancer, les maladies neurodégénératives, et même le syndrome post-traumatique), on peut observer un dysfonctionnement mitochondrial, avec production d'un excès de ROS. Contrairement à ce qui peut être dit sur internet (traitements alternatifs souvent onéreux, avec présentation publicitaire soutenue par un discours pseudo-scientifique, dépourvu de toute preuve) il n'existe aucune formule magique pour "booster" nos mitochondries, mais il est déjà important d'identifier là un problème physiologique fondamental qui mérite des investigations approfondies (notamment en luttant contre l'excès de ROS). Et qui doit inciter à adopter une hygiène de vie favorable à un meilleur fonctionnement de ces mitochondries.
Cercles vicieux (boucles de rétroactions positives)
Dans les facteurs qui contribuent à la chronicité des SPI, il peut donc y avoir, de façon non systématique, des pathogènes comme le pathogène déclencheur persistant, ou des pathogènes secondaires, détaillés ci-dessus. Mais la revue montre aussi que sur certains terrains individuels, une réponse anti-infectieuse initiale peut se trouver auto-entretenue par des boucles de rétroaction, des cercles vicieux qui peuvent perdurer même si le pathogène initial a disparu. J'ai identifié 4 cercles vicieux possibles (et ils sont probablement bien plus nombreux), 4 boucles inflammatoires auto-entretenues potentielles.
- La première est formée par le triangle entre 3 types de cellules immunitaires distinctes, les lymphocytes T, les lymphocytes B et les monocytes, chacun de ces types cellulaires pouvant activer et être activé par les 2 autres, une propriété très utile dans une réponse anti-infectieuse, mais qui peut "déraper" en cercle vicieux hors de contrôle, notamment dans les maladies auto-immunes, comme la sclérose en plaque.
- La deuxième boucle implique la microglie. Dans le cerveau, les cellules microgliales sont vitales en temps normal pour contrôler et assurer la qualité d'un environnement non inflammatoire des neurones. Mais, en réponse à une infection ou à un contexte inflammatoire, ces cellules microgliales peuvent basculer dans un état pro-inflammatoire, en étant à la fois productrices de cytokines inflammatoires (comme le TNF-a ou l'IL-1b), et être activées par ces mêmes molécules. Comme si un bon chien de garde se transformait en loup.
- La troisième boucle peut être provoquée par des niveaux excessifs de ROS produits par des mitochondries dysfonctionnelles. Cette surproduction de ROS aggrave leur dysfonctionnalité en entraînant une diminution de la production d’ATP et une augmentation de la production de ROS.
- La quatrième boucle peut être due à la translocation bactérienne à travers une muqueuse intestinale enflammée et endommagée, ce qui peut entretenir l’inflammation et la perméabilité de la muqueuse.
Influence du système nerveux sur la chronicité des SPI.
Cette partie de la revue commence par le § suivant:
Les syndromes post-infectieux aigus ne peuvent être envisagés uniquement d'un point de vue moléculaire/cellulaire, ni d'un point de vue purement psychique. Ces deux dimensions du SPI doivent être prises en compte afin de pouvoir décrypter leurs interactions. Cette dualité est absolument nécessaire, mais représente un véritable défi, car ces deux dimensions correspondent à des champs épistémiques traditionnellement différents.
J'ai dit en introduction mon désaccord avec ceux qui ne misent que sur les antibiothérapies prolongées, pour la maladie de Lyme, comme avec ceux qui envisagent exclusivement la composante psychosomatique, et semblent tout ignorer des questions physiologiques. Tournons le dos à ces deux erreurs, et voyons quelle peut être l'influence du système nerveux sur la chronicité des SPI.
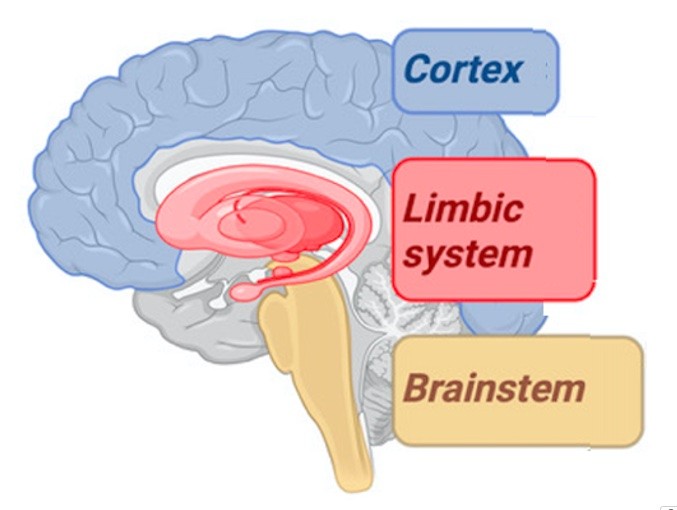
Parler du système nerveux, c'est inclure à la fois (et de façon non exhaustive), le cerveau, le système nerveux autonome (SNA), le système nerveux sensoriel. Dans la revue, il est montré que dans le cerveau, il importe de distinguer 3 étages 1) le tronc cérébral, dans lequel on trouve des noyaux impliqués dans le contrôle automatique (du cœur, du poumon, du péristaltisme intestinal) 2) Le système limbique, dans lequel différentes structures (l'hypothalamus, l'amygdale) intègrent des informations concernant l'inflammation, le stress, les émotions 3) Le cortex, siège des fonctions les plus "nobles" (pensée, mémoire, motricité, parole, lecture, prise de décision etc…). Ces différentes parties fonctionnent comme un réseau global hyper-connecté.
Figure 1. Les 3 étages du cerveau, cortex, système limbique et tronc cérébral (brainstem).
Dans le SNA, on distingue les voies afférentes, qui apportent des informations au cerveau, et des voies efférentes, qui transmettent des informations du cerveau vers les autres organes. Une autre distinction concerne le SNA sympathique, indispensable à l'action. Il permet d'accélérer le cœur, la respiration, de mobiliser le glucose vers le sang pour faire tourner plus vite les mitochondries. Il met aussi en veille ce qui n'est pas indispensable à l'action (système immunitaire, digestion). Toutes ces fonctions sont très coordonnées entre elles. Le SNA parasympathique joue le rôle opposé : il favorise la digestion, le fonctionnement du système immunitaire, ralentit cœur et respiration etc... Notre homéostasie normale prend appui sur la tension permanente et nécessaire entre ces deux systèmes qui s'équilibrent, s'activent à tour de rôle. Si l'un des deux systèmes prend le dessus de façon prolongée, on passe de l'homéostasie à un état dyshoméostatique. Dans les SPI, il y a en général une dominance du SNA sympathique (à tendance pro-inflammatoire) et une faiblesse du SNA parasympathique (anti-inflammatoire). Ce dysfonctionnement du SNA se nomme dysautonomie. Etant donné le grand nombre d'organes contrôlés par le SNA, cette dysautonomie peut se manifester par de très nombreux symptômes différents.
Parmi les manifestations de dysautonomie, on notera en particulier le POTS (Postural Orthostatic Tachycardia Syndrome, syndrome de tachycardie orthostatique posturale) et le PEM (Post-Exercise Malaise, malaise post-exercice). Qu'est-ce que le POTS, ou intolérance orthostatique ? L'effort que doit faire notre cœur pour envoyer du sang au cerveau est logiquement plus faible lorsque nous sommes en position horizontale qu'en position verticale. En temps normal, lorsque l'on se redresse, notre SNA ajuste automatiquement le contrôle cardio-vasculaire pour que ce changement de position n'ait aucune conséquence sur l'irrigation du cerveau. Quand on souffre de POTS (d'intolérance orthostatique), la verticalisation peut entrainer une tachycardie marquée, un étourdissement, qui peuvent durer plusieurs minutes. Le POTS est un signe clair de dysfonctionnement du SNA, donc de dysautonomie. C'est un des symptômes possibles (mais pas systématique) des SPI. Le PEM se manifeste par une aggravation retardée et anormale de divers symptômes et une perte d'énergie suite à des stress physiques ou cognitifs minimes ou à d'autres déclencheurs qui auraient été normalement tolérés avant l'apparition de la maladie. Comme le POTS, le PEM est un des symptômes possibles (mais pas systématique) des SPI. Il est très fréquent dans le SFC et les formes sévères de Covid long.
Jusque là, pour présenter l'homéostasie, j'ai fait appel uniquement au SNA. La réalité est plus complexe. Le SNA (purement nerveux) est doublé d'un réseau neuro-endocrinien, l'axe HPA (Hypothalamus-Pituitary-Adrenal, en française Hypothalamus-Hypophyse-Glande surrénale). Les communications entre ces 3 organes (dont deux noyaux cérébraux) se faisant par des hormones libérées dans le sang. Chez une personne en bonne santé, une simulation soudaine de l'axe HPA permet une réaction physique, motrice, très rapide. On parle de réponse flight or fight (sauve-toi ou bats-toi), par exemple si on se trouve face à un fauve. Cette réponse, coordonnée par l'axe HPA permet de mobiliser plus de glucose, pour avoir plus d'ATP, d'accélérer la fréquence cardiaque, de mettre en repos digestion et réponse immunitaire (en parallèle à l'action du SNA sympathique). Cette réponse, qui met en jeu une libération de cortisol et d'adrénaline par la glande surrénale, est anti-inflammatoire par ailleurs (l'effet anti-inflammatoire des corticoïdes est bien connu). Mais une stimulation chronique de l'axe HPA le fait dysfonctionner durablement, et il devient pro-inflammatoire. C'est ce qu'on observe dans de nombreuses pathologies chroniques, dont les SPI. Un point très important : le déclenchement de l'axe HPA part d'un noyau de l'hypothalamus qui peut être activé aussi bien par un stress psychologique que par une inflammation (suite à une infection par exemple). Ce fait est déterminant pour comprendre que les personnes souffrant d'une maladie inflammatoire chronique souffrent en général aussi d'une mauvaise gestion de stress, même de faible intensité. Cette donnée scientifique majeure est en général ignorée des psychosomaticiens.
D'autres notions discutées dans la revue sont celles d'intéroception et de système neuroimmunitaire. Il est rappelé que l'intéroception est un processus par lequel le cerveau 1) perçoit, intègre et interprète les signaux provenant du corps et 2) envoie des rétroactions visant à maintenir l'homéostasie. Parfois ces rétroactions sont inappropriées, excessives ou insuffisantes, ce qui peut contribuer à la dyshoméostasie et faire apparaitre des symptômes. Par ailleurs, notre système nerveux et notre système immunitaire, s'ils sont distincts, fonctionnent de façon étroitement couplée, chacun étant capable de modifier le fonctionnement de l'autre, d'où le concept de système neuro-immunitaire.
La revue examine aussi les liens forts qui existent entre inflammation, nociception (qui dépend de certains neurones sensoriels) et dépression, un autre ensemble de données généralement ignoré des psychosomaticiens, comme des tenants du "tout physiologique". Que les premiers aient trop souvent recours à l'affirmation "Cette maladie, c'est dans votre tête" a peut-être poussé les seconds à ignorer l'implication du système nerveux dans ces pathologies. Ce sont deux formes d'ignorance très fréquentes, confortées par l'illusion de la connaissance, obstacle majeur à une réelle compréhension.
Une section de la revue est consacrée à la distinction entre une fatigue physiologique et la fatigue pathologique. La fatigue physiologique est un état interne qui prévient le surmenage et permet la réaffectation et la restauration des ressources énergétiques. Elle est atténuée par le repos et/ou le sommeil. La perception (forcément cérébrale) d'une fatigue physiologique a été sélectionnée par l'évolution pour son utilité homéostatique, alors que la fatigue pathologique révèle un état dyshoméostatique. Elle est le reflet d'un dysfonctionnement combiné de nombreux systèmes potentiels. La fatigue pathologique est liée à la fois à des problèmes physiologiques (inflammation chronique, dysfonctionnement mitochondrial, pathologies cardio-pulmonaires, endocrinopathies, carences vitaminiques) et à des processus intéroceptifs, avec des corrections cérébrales inappropriées des perturbations physiologiques, avec éventuellement des répercussions psychiques.
Conclusion
En résumé, les principales hypothèses auxquelles je fais appel pour tenter de comprendre les SPI sont les suivantes.
- Mon désaccord avec les tenants d'explications soit "tout physiologique" soit psychosomatique des SPI est basé sur la conviction qu'il est impossible de comprendre correctement les SPI sans prendre simultanément en compte des phénomènes aussi divers que la fatigue, l’hypométabolisme, le dysfonctionnement mitochondrial, l’inflammation, la dysbiose intestinale, l’auto-immunité, la dysautonomie, l’intolérance orthostatique (POTS) et l'intolérance à l'effort (PEM), la mauvaise gestion du stress, entre autres concepts divers mais connectés entre eux.
- La chronicité des SPI est multifactorielle. Elle implique toujours des terrains individuels initiaux particuliers, très variables selon les patients, avec des facteurs de risques multiples pouvant inclure 1) un système immunitaire sous-optimal (hypo-réactif) 2) Une propension à déclencher, après une infection, des formes d'auto-immunité (beaucoup plus fréquente chez les femmes que chez les hommes) 3) Un terrain allergique 4) Une faible résistance au stress 5) Un fonctionnement mitochondrial sous-optimal.
- Ce terrain initial a une composante génétique, donc héréditaire, qui se combine avec de nombreux facteurs non génétiques : l'histoire infectieuse antérieure, le mode de vie, l'hygiène alimentaire, l'environnement social (quand il est hostile, source de souffrance).
- Ces différentes fragilités initiales (ou facteurs de risques) peuvent se combiner ensuite avec la persistance possible (pas systématique) du pathogène initial, et la mise en jeu de pathogènes secondaires (réactivation de virus endogènes, translocation intestinale, etc.). En outre, une fois l'équilibre initial (la bonne santé) rompue, le retour vers la santé peut être bloqué par des cercles vicieux auto-entretenus détaillés plus haut, impliquant surtout le système immunitaire, l'inflammation et en particulier la neuro-inflammation.
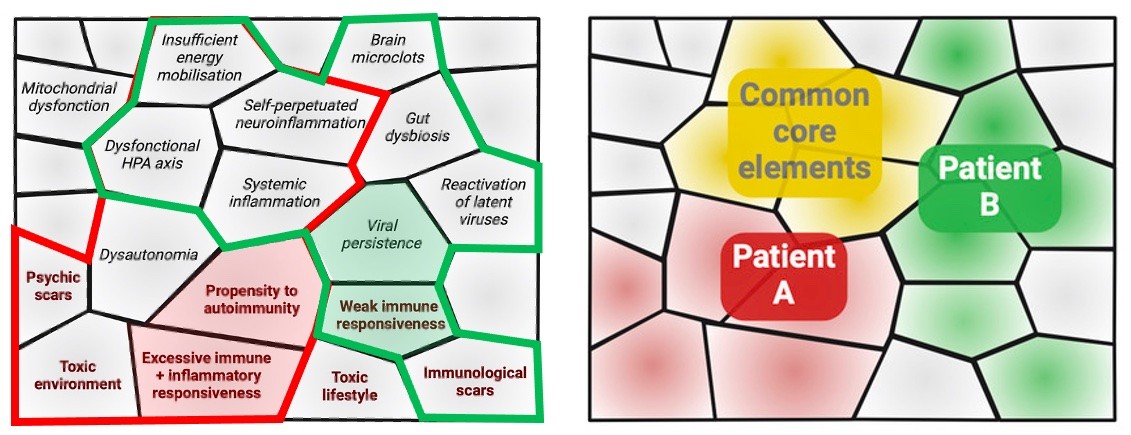
Je propose un schéma où chacun de ces mécanismes potentiels (fragilités initiales + boucles auto-entretenues) constitue une brique, ou plutôt un "building block", qui n'implique pas l'uniformité géométrique associée aux briques. Le SPI de chaque patient peut être vu comme un assemblage de tels building blocks très différents, dont certains sont communs à quasiment tous les SPI (comme la fatigue), et d'autres sont beaucoup plus variables.
Figure 2. Les building blocks d'un SPI peuvent s'auto-assembler, se consolider mutuellement. Ils diffèrent a priori entre deux patients. Mais il y a aussi des building blocks, et donc des symptômes, communs.
Un tel schéma permet de rendre compte du fait que différents SPI (Covid long, SFC, Lyme long) ont de nombreux points communs, mais que les tableaux cliniques de deux patients souffrant du même SPI (Covid long par exemple) peuvent être très différents.
La revue se conclut par des propositions d'amélioration du diagnostic des SPI. Les patients attendent … impatiemment des essais cliniques concluants. Une difficulté majeure de ces derniers réside dans l'hétérogénéité de présentation clinique des SPI, reflétant, on l'a vu, la diversité des terrains individuels initiaux. Des essais cliniques concluants devront nécessairement être effectués sur des sous-groupes de patients relativement homogènes (avec des terrains de départ apparentés). La constitution rationnelle de tels sous-groupes nécessite une amélioration sensible du diagnostic, qui devrait faire appel à une combinaison de questionnaires, de biomarqueurs, et de tests fonctionnels. Et enfin des méthodes d'analyse non supervisée de cette masse de données, avec l'aide de l'intelligence artificielle.